 |
Bubblor i en läskedryck sedda i förstoring. Förstår man de faktorer som gör att bubblor bildas så förstår man också orsakerna till dykarsjuka och flera andra fysiologiska mekanismer. Läs mer om kolsyrade drycker och djurfysiologi nedan. Courtesy of Spiff, in the public domain. |
|
Gaserna syre, koldioxid och kväve förekommer inte bara i gasform i luften utan också lösta i vatten, bland annat i våra och andra djurs kroppsvätskor. I luften beter sig alla gaserna på samma sätt. Men i vatten är det annorlunda. Koldioxid är lättlösligt i vatten, syre och kväve svårlösliga. Detta får en hel rad intressanta konsekvenser. När vatten är i jämvikt med luft avseende syre, är syrets koncentration i vattnet cirka 30 gånger lägre än i luften. Syre är således en bristvara för vattenlevande djur. Den höga syretillgången på land gör att landdjur kan ha en högre energiomsättning, något som troligen underlättat utvecklingen av komplicerat byggda nervsystem och uthålliga muskler. Syrets låga vattenlöslighet är också orsaken till att vi behöver syrebindande hemoglobin i blodet. Om man ökar trycket i gasfasen, löser sig mer gas i vattnet. Detta är orsaken till att dykare kan drabbas av dykarsjuka. Men vi börjar med koldioxid och kolsyrade drycker.
Man åstadkomma en imponerande kaskad av läsk och skum genom att släppa tabletter av godiset Mentos i en flaska kolsyrad läskedryck. Vad som händer är att de koldioxidmolekyler, som är lösta i läsken, mycket snabbt lämnar vätskan och ger upphov till stora mängder koldioxid i gasform. Man ska absolut inte äta Mentos före, efter eller under det att man dricker kolsyrade drycker. Det är farligt och kan mycket väl leda till skador på magtarmkanalen. Enligt en uppgift spridd på nätet skulle två barn ha dött, efter att ha ätit Mentos och samtidigt druckit Coca-Cola. Detta är bara en vandringssägen. Sådana sprids blixtsnabbt på nätet. Men ingenting blir sant bara för att det upprepas många gånger. De som dumt nog försökt äta Mentos och dricka läsk samtidigt, har emellertid drabbats av kraftig gasutveckling i mag-tarmkanalen. En kaskad av vätska och gas har sprutat ut genom munnen och de har varit mycket medtagna efteråt.
Kolsyrade dryckers fysik och kemi

Men varför blir det en så explosiv reaktion mellan Mentos och kolsyrade drycker? För att svara måste jag berätta en del om hur gasmolekyler beter sig lösta i vatten, något som är av stor fysiologisk betydelse. När man kolsyrar läsk, bringar man vätskan i kontakt med koldioxidgas med mycket högt tryck, betydligt högre än atmosfärstrycket. En stor mängd koldioxidmolekyler kommer då att vandra ner i vätskan med så kallad diffusion, drivna av det höga gastrycket ovanför vätskan. Sedan försluter man flaskan. Överst i flaskan, ovanför läsken, finns då koldioxidgas med mycket högt tryck. Läs om hur diffusion fungerar på en annan sida. Texten fortsätter under faktarutan.
 |
 |
Hur uppkommer bubblor i ett vattenglas?

Till vänster ses, inte en storm, men väl gasbubblor i ett vattenglas. Hur har de uppkommit? Jo, kallt vatten som hällts i bägaren har värmts upp, dock ej till kokpunkten. Alla gaser har högre löslighet i vatten, ju lägre temperaturen är. Detta innebär att vatten kan rymma fler gasmolekyler per volymenhet vid låga temperaturer, än vid höga. Gaskoncentrationerna är då höga. Det kalla vattnet i glaset har från början varit i kontakt med luft. Då har framför allt syre och kväve från luften löst sig i vattnet tills dess att diffusionsjämvikt uppnåtts. Vid jämvikt sker ingen nettotransport av gasmolekyler mellan vattnet och luften. Sedan har vattnets temperatur stigit vid uppvärmningen, varvid gasernas löslighet minskat. Vattnet blir då övermättat på syre och kväve. Det innebär att jämvikt inte längre råder. Vattnet innehåller "för mycket" syre och kväve. Tillståndet är inte längre stabilt. De lösta gasmolekylerna tenderar därför att övergå i gasform som små bubblor. Detta finns emellertid en viss tröghet i systemet, mycket beroende på att vattnets ytspänning måste övervinnas, när bubblor bildas. Bildning av gasbubblor underlättas där det finns groddar, små strukturer som kan binda gasmolekyler. Det är därför som bubblorna bildas främst vid glasets vägg, där det finns små ojämnheter eller små föroreningar, som överlevt disken. Dessa strukturer fungerar som groddar för bildning av gasbubblor.
Gasers ökade löslighet vid låga och minskade vid höga temperaturer har betydelse för djurs syretillgång. I varmt stillastående vatten uppkommer lätt syrebrist. Sådant vatten är vanligt i tropikerna. Läs på en annan sida om hur många fiskar löst sitt syreproblem genom att andas luft. Å andra sidan har arktiska och antarktiska fiskar en god tillgång på syre på grund av vattnets låga temperatur. Läs på en annan sida om fiskar som i iskallt vatten klarar sig utan syrebindande hemoglobin.
Till höger ses en champagnekork. Läs i texten nedan om varför den kan fungera som en farlig projektil. Courtesy of Mehinger (left) from Wikimedia Commons under Creative Commons Attribution-Share Alike 4.0 International Licence and Julo (right), in the public domain. |
|
När man öppnar en läskedrycksflaska sjunker gastrycket ovanför läsken och blir lika med atmosfärstrycket. Man hör ju hur gas pyser ut. Nu är läsken övermättad på koldioxid, det vill säga den innehåller fler koldioxidmolekyler än som "får plats" vid det låga koldioxidtryck som råder i luften. Öppnar man en flaska försiktigt, i synnerhet om den är kyld, kommer den lösta koldioxiden långsamt med hjälp av diffusion att övergå till koldioxidgas, varvid gasbubblor bildas i läsken. Till slut inträder jämvikt, utan någon nettotransport av koldioxid mellan läsk och luft. Då är läsken "avslagen".
Men det finns ett antal faktorer som kan påskynda bildningen av koldioxidgas, flera av dem välkända för den erfarne läskkonsumenten. Om man värmer läsken, minskar koldioxidens löslighet i vatten och mer gas bildas. Om man skakar om läsken, kommer mer läsk i kontakt med luften och med så kallade groddar. Groddar är små korn i läsken eller ojämnheter på flaskans insida. Koldioxid kan bindas till groddarna, vilket påskyndar bildningen av koldioxidbubblor. De ovan nämnda Mentostabletternas yta är ojämn, försedd med ett otal mycket små gropar. Ojämnheterna verkar vara utformade så att de fungerar som utomordentligt bra groddar för bubbelbildning. Detta är med stor sannolikhet en mycket viktig orsak till Mentosens spektakulära effekt. En viktig orsak är också att en Mentostablett sjunker till botten av flaskan. Då bildas koldioxidgasen längst ner i flaskan och pressar drycken uppåt mot flaskans mynning. Andra orsaker är troligen sötningsmedlet aspartam, som finns i sockerfria läskedrycker, och konserveringsmedlet kaliumbensoat, som är en vanlig livsmedelstillsats. Dessa ämnen verkar minska det energitillskott som behövs för att bubblor ska bildas. Texten fortsätter under videon.
|
I denna video testas hypotesen att Mentostabletternas yta har en oregelbunden struktur med ett otal små fördjupningar, som fungerar som groddar för bildning av koldioxidbubblor. När en Mentostablett släpps ner i en flaska med sodavatten, stiger en fontän av dryck upp ur flaskan. Man testar också en liknande tablett som dragerats med ett vaxlager. Vaxlagret jämnar ut tablettens yta och döljer groddarna. När en sådan tablett släpps ner i en flaska sodavatten, bildas mycket färre bubblor och ingen fontän stiger upp ur flaskan. From YouTube, courtesy of Mythbusters. |
|
Det höga trycket i gasutrymmet ovanför läsken kan utgöra en fara. I sällsynta fall kan flaskor explodera. Detta gäller i ännu högre grad kolsyrade viner, som champagne. Dessa viners korkar kan ju också flyga i väg som projektiler. Skador orsakade av avfyrade champagnekorkar förekommer, enligt uppgift, särskilt i Frankrike. En större gasvolym ovanför drycken ökar risken. Gasens tryckenergi är nämligen lika med volymen multiplicerat med trycket. Om det inte funnits någon gas mellan drycken och korken hade risken eliminerats. Trycket i drycken skulle fortfarande vara högt, men detta skulle inte kunna leda till någon explosion vid öppnandet. Orsaken till detta är att vätskors volym, till skillnad från gasers, knappast alls ökar när trycket sjunker. Tillverkarna av champagne och läsk säger dock att det är tekniskt omöjligt att eliminera gasutrymmet i flaskorna.
Syretiilgången för landdjur och vattendjur

Så lämnar vi de kolsyrade dryckerna och återvänder till djurvärlden. Som ovan nämnts, gynnas landdjur av den höga syrehalten i luft, jämfört med vatten. Detta gör att de kan ha en högre energiomsättning, något som sannolikt underlättat utvecklingen av komplicerat byggda organismer. Det möjliggör också uthålligare och intensivare muskelarbete. Energikostnaden för andningen, alltså utbytet av syre och koldioxid med omgivningen, är dessutom mycket lägre på land än i vatten. Troligen har den höga syrehalten också underlättat utvecklingen av avancerade hjärnor. Mycket få vattenlevande djur har utvecklat hög kognitiv förmåga ("intelligens") och komplicerad social samverkan. Ett undantag är vissa bläckfiskar, som i beteendeförsök uppvisat förvånansvärt avancerad kognition. Men dessa havets intellektuella giganter, skulle aldrig kunna utveckla en hög kultur, lik människans. Andra orsaker till detta är deras korta livslängd och det faktum att de aldrig skulle kunna lära sig att behärska elden, som olyckligtvis släcks av vatten. Läs mer om skillnaderna mellan vattenliv och landliv på en annan sida.
Landdjurens vattenproblem

Den största nackdelen med att leva på land är att mycket vatten förloras genom avdunstning från kroppsytan och från andningsorganen, i synnerhet i torra miljöer. Väl anpassade landdjur måste därför ha en hud som är mycket vattentät. Däggdjur vattentätar huden med hjälp av dess översta döda hornlager, som är impregnerat med vattenskyende fettämnen. Insekter vattentätar sitt yttre skelett, kutikulan, med hjälp av ett mycket vattentätt vaxlager. Däggdjuren minskar vattenförlusterna via andningen genom att återvinna vatten i näshålan, där vattenånga kondenseras till flytande vatten på de kalla näsmusslorna. Insekternas andningsorgan utgörs av ett i hela kroppen förgrenat luftfyllt rörsystem, trakéerna. Ett sådant system avger mindre vattenånga till omgivningen, än vad lungor gör. Dessutom kan trakérörens mynningar stängas, när syreförbrukningen är låg. Läs om däggdjurens vattentätade hud och om hur däggdjur sparar vatten med hjälp av "vattenväxlare" i nosen på andra sidor. Läs också om insekternas trakésystem och om hur de kan spara vatten vid andningen på en annan sida.
Det är förvånande få djurgrupper som är så väl anpassade till landliv, att de kan leva i torra miljöer och är oberoende av vatten för sin fortplantning. Egentligen är det bara insekter, spindeldjur, kräldjur inklusive fåglar och däggdjur. Landlevande ringmaskar (t.ex. daggmaskar), rundmaskar, snäckor, kräftdjur (t.ex. gråsuggor) och groddjur måste nästan alla leva i fuktiga miljöer. En del av dessa djur (t.ex. de flesta groddjur) måste dessutom fortplanta sig i vatten. Texten fortsätter under videon.
|
Videon visar blodflöde i kapillärer. Kapillärerna är de minsta blodkärlen, över vars väggar utbytet av syre och koldioxid med de omgivande vävnadscellerna äger rum. Man ser röda blodkroppar, som snabbt rör sig genom kärlen. Blodkropparna är fyllda med syrebindande hemoglobin, som mycket snabbt avger sitt syre. Syret transporteras sedan med diffusion genom kapillärväggarna till cellerna utanför dem. Utan hemoglobin hade blodet varit en mycket dålig syretransportör, se texten nedan. Hemoglobinets röda färg syns inte i bilden, eftersom det röda ljuset från enstaka blodkroppar är så svagt att det absorberas innan det når ögat. Notera att kapillärerna är så smala att de bara släpper igenom en blodkropp åt gången, ställvis så smala att blodkropparna måste deformeras för att passera.
Det är värt att påpeka att koldioxid huvudsakligen transporteras i blodplasman, vätskan utanför blodkropparna, inte inne i dem. Där transporteras koldioxiden huvudsakligen i form av vätekarbonat (HCO3-), i mindre utsträckning i form av löst koldioxid (CO2). En del koldioxid binds till hemoglobinet, men inte till bindningsstället för syre. Det finns två orsaker till att hemoglobinet inte är så viktigt för koldioxidtransporten. För det första har koldioxid mycket högre löslighet i vatten än syre. För det andra reagerar koldioxiden med vatten, varvid kolsyra bildas. Kolsyran dissocieras till vätekarbonat och vätejoner, som båda är mycket vattenlösliga. From YouTube, courtesy of D. M. Sparks. |
|
Syrets transport i blodet

Syrets låga vattenlöslighet ger upphov till ett stort problem, när det ska transporteras i blod genom kärlsystem. Transporten är mycket ineffektiv, om blodet bara transporterar lösta syremolekyler. Koncentrationen av lösta molekyler är ju mycket låg. De flesta djur med blodkärlssystem har därför syrebindande andningspigment i blodet. Den mest kända syrebindande molekylen är det röda hemoglobinet. Hemoglobin har en mycket stor benägenhet att binda syre. Därmed rymmer blodet betydligt mer syre än de fria lösta molekylerna. Tack vare hemoglobinets stora benägenhet att binda syre blir den totala syrekoncentrationen i blodet (mätt som gram syre per liter blod) i storleksordningen 100 gånger högre än den annars skulle vara. Nästan allt detta syre är bundet till hemoglobinet. Koncentrationen av fria syremolekyler är fortfarande mycket låg.
Hjärtan är muskeldrivna pumpar. Utan hemoglobin hade människans hjärta, teoretiskt sett, behövt pumpa ut i storleksordningen 100 gånger mer blod per tidsenhet för att förse kroppen med den normala syremängden. Det finns inga muskler som klarar av att dra ihop sig tillräckligt snabbt och ofta för att klara av detta arbete. Och ett hjärta med 100 gånger större volym är en anatomisk omöjlighet. Läs mer om hur hemoglobin fungerar och om andra andningspigment på en annan sida.
Dykarsjuka

Gasers lösta i kroppsvätskorna ställer till problem för dykare och kan bland annat orsaka så kallad dykarsjuka ("bends", tryckfallssjuka). För att förstå dykarsjuka, måste vi först ge lite bakgrundsfakta. Ju högre trycket för en gas är i luft, ju mer gas löses i en vattenlösning som är i kontakt med luften. Gasen löses i vattnet tills diffusionsjämvikt nås. Vätskan är då mättad avseende gasen. Detta diskuterades ovan för kolsyrade drycker. I luft beter sig de olika ingående gaserna som om de andra gaserna inte existerade. Man kan därför tala om ett partialtryck för varje gas. Torr luft innehåller 20,9 volymprocent syre och 78,1 volymprocent kväve. Om det totala lufttrycket i torr luft är 760 mm Hg (1� 0�1�3� �h�P�a� eller 1 atm; atm betyder atmosfär), kan man med hjälp av procenttalen räkna ut avrundade partialtryck för syre på 159 mm Hg eller 0,2 atm och för kväve på 594 mm Hg eller 0,8 atm. Vi använder i fortsättningen enheten atm, där 1 atm är det normala lufttrycket vid havsytans nivå. I fuktig luft, som innehåller vattenånga, kommer partialtrycken för syre och kväve att vara lägre än de ovan nämnda. Vi försummar denna effekt av vattenånga i luften.
Trycket i vatten ökar med djupet under vattenytan, närmare bestämt med cirka 1 atm för var tionde meter. Vattentrycket är således 2 atm på 10 meters djup, 3 atm på 20 meters djup, 4 atm på 30 meters djup och så vidare. Äntligen är det så dags för dykaren att göra entré. Kroppsvätskorna är vid början av ett dyk i jämvikt med luft med partialtrycken 0,8 atm för kväve och 0,2 atm för syre. En dykare, som andas luft från gastuber, kommer på tjugo meters djup andas in luft med samma totaltryck som det omgivande vattnets, det vill säga 3 atm. I inandningsluften har partialtrycket för kväve då tredubblats till 2,4 atm och för syre till 0,6 atm. Nu inträder samma situation som då man kolsyrar läskedrycker. Kväve och syre kommer att transporteras från lungorna via blodet till alla kroppens vävnader och koncentrationerna av fria gasmolekyler stiger i vävnadsvätskorna. De koncentrationer av gaserna som nås beror dels på djupet under vattenytan, dels på den dyktidens längd. Texten fortsätter under bilderna.
 |
 |
Till vänster ses en rekonstruktion av en dykarklocka av den typ som användes på 1600-talet, bland annat vid bärgningen av regalskeppets Vasas kanoner. Den sänktes ner i vattnet tillsammans med en dykare. Dykaren kunde andas i den luftficka som fanns upptill i klockan. Luften komprimerades emellertid när klockan sänktes ner, så att dess volym blev liten på större djup. Dessutom var luftförrådet minimalt. Från och med slutet av 1600-talet utvecklades bättre dykarklockor. Man utvecklade metoder att tillföra ny luft, först från nedsänkta luftfyllda tunnor, sedan via pumpar. Man kunde också släppa ut den gamla luften genom en ventil upptill på klockan. Därmed minskade man risken för att dykaren skulle drabbas av syrebrist och koldioxidförgiftning. Men på grund av det höga trycket kvarstod risken för dykarsjuka, en sjukdom som drabbade många dykare i äldre tider, ofta med dödsfall som följd. Till höger ses en modern dykare. Han gör en av de pauser i uppstigningen, som måste göras för att minimera risken för dykarsjuka, och mäter tiden med hjälp av sin dykarklocka, det vill säga ett vattentätt ur. Courtesy of Karlskrona Marinmuseum, in the public domain (left) and John Martin Davies, from Wikimedia Commons under Creative Commons Attribution-Share Alike 3.0 Unported License (right). |
|
Om dykaren snabbt dyker upp till vattenytan, inträder samma situation som då man öppnar en läskedryck. Kroppsvätskorna är övermättade på kväve och syre. Dykaren har inte hunnit andas ut överskotten av gaserna. Då bildas små gasbubblor i vävnaderna. Kvävet ger de största problemen, eftersom syrehalten är lägre än kvävehalten och syret dessutom förbrukas av kroppen. Detta är dykarsjuka, som orsakas både av bubblorna i sig och av processer som bubblorna orsakar i kroppen. Symptomen kan i lindriga fall inskränka sig till missfärgad hud, klåda och ledsmärtor. I allvarliga fall drabbas dykaren av andningsproblem, yrsel, förlamning och medvetslöshet, i värsta fall döden.
Dykarsjuka förebygges genom att dykare måste stiga upp stegvis, med pauser på olika djup. Då kan överskottet på kväve andas ut och bubblor bildas inte i kroppen. Schemat är anpassat efter dykdjupet och dyktiden. Om dykarsjuka uppkommit, får dykaren vistas i en tryckkammare med högre lufttryck än i atmosfären. Då löser sig bubblorna vanligen i kroppsvätskorna. Sedan sänker man gradvis trycket i kammaren, så att kvävet kan andas ut utan bubbelbildning. Vid långvariga dyk till stora djup kan kvävet i gastuberna ersättas med helium, som lämnar vävnaderna snabbare än kväve. Läs om hur dykande däggdjur och fåglar undviker dykarsjuka och om hur sälar kan dyka så länge
utan att andas på andra sidor.
Ett annat av de många problem, som måste undvikas vid dykning, är kväveberusning (djupberusning) med därav följande omdömeslöshet. Vid höga koncentrationer har kväve (N2) nämligen liknande effekter som lustgas (dikväveoxid, N2O).
|
Gasers löslighet och Henrys lag

För den intresserade ges här en fördjupad förklaring till de processer som diskuteras ovan. En gas kallad G finns dels i luften ovanför en vattenlösning, dels löst i vattenlösningen. Mellan luft och lösning är det diffusionsjämvikt avseende gasen G. Det innebär att det finns ett utbyte av gasmolekyler mellan luft och lösning, men ingen nettotransport i endera riktningen (se pilarna). Lösningen är då mättad på gasmolekyler. Då gäller Henrys lag:
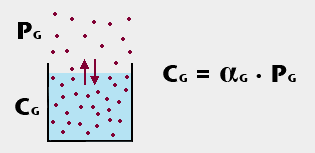
Förklaring av bilden:
- Prickarna symboliserar gasmolekyler.
- PG är gasens partialtryck (mm Hg eller hPa) i luften. Ökar trycket i luften kommer mer gas från luften att lösas i vattnet. Detta händer när man kolsyrar läsk och när en dykare dyker neråt. Minskar trycket i luften blir vattnet övermättat på gasen och gasbubblor bildas. Detta händer när man öppnar en läskflaska och när en dykare dyker uppåt för snabbt.
- CG är gasens koncentration (gram/liter) i vattnet. Den ökar, när gastrycket i luften ökar, och minskar, när gastrycket där minskar.
- αG är gasens löslighet (löslighetskoefficient) i vatten. Den är mycket låg för syre och kväve, mycket hög för koldioxid. Det är därför som hemoglobin är nödvändigt för blodets syretranport, men mindre viktig för dess koldioxidtransport.
- För alla gaserna gäller att αG ökar vid minskad temperatur och minskar vid ökad temperatur. Det är därför som läsken blir övermättad och bildar koldioxidbubblor vid uppvärmning. Det är också därför som djur i kalla vatten har tillgång till mer syre än djur i varma vatten.
I den schematiska bilden nedan är partialtrycket, PG , i luften ovanf–r vattnet lika stor för alla de tre gaserna. Temperaturen är också lika stor. Det sker inte heller nÂgon nettodiffusion mellan luften och vattnet. Diffusionsj”mvikt rÂder sÂledes i alla tre fallen. Man ser skillnaderna i CG mellan gaserna. Koncentrationen av den vattenl–sligare koldioxiden ”r ungef”r lika stor i luften som i vattnet. Koncentrationerna av de dÂligt vattenl–sliga gaserna syre och kv”ve ”r d”remot mycket l”gre i vattnet ”n i luften.
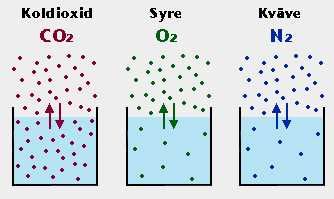
När jämvikt avseende en gas råder mellan luft och en vattenlösning, säger man att gasens partialtryck råder också i vattenlösningen. Detta är en egendomlig terminologi, eftersom gasen inte utövar något gastryck i vattenlösningen. Men den är nödvändig för att kunna beskriva gasers diffusion i vatten och mellan vatten och luft.
|
|
Referenser
K. E. Barrett, S. M. Barman, S. Boitano, and H. L. Brooks: Ganong's review of medical physiology (23rd ed, McGraw-Hill Lange, 2010).
C. Bothin: Dykarsjuka (Internetmedicin.se, retrieved 20 June 2016).
C. W. Bryant: What's a diving bell? (HowStuffWorks, retrieved 21 June 2016).
T. S. Coffey: Diet Coke and Mentos: what is really behind this physical reaction? (American Journal of Physics 6:551-556, 2008).
K. Dodde, B. Dodde, and I. MacQuarrie: Diving bells and observation chambers (Diving Heritage, retrieved 21 June 2016).
R. W. Hill, G. A. Wyse, and M. Anderson: Animal Physiology (3rd ed, Sinauer, 2012).
K. V. Kardong: The vertebrates (5th ed, McGraw-Hill, 2009).
B. Mikkelson: Non compos Mentos (Snopes.com, updated 9 November 2006).
Widmayer, H. Raff, and K. T. Strang: Vander's human physiology (12th ed, McGraw-Hill, 2011).
P. Willmer, G. Stone, and I. Johnston: Environmental physiology of animals (2nd ed, Blackwell, 2005).
Till början på sidan
Till "Djurfakta"
|